喇叭杜鹃组培快繁技术的研究
喇叭杜鹃(RhododendrondiscolorFranch.)常绿灌木或小乔木,属杜鹃花科(Ericaceae)杜鹃花属(Rhododendron),生于海拔900-1900米的林下或密林中。该物种花型美丽,颜色鲜艳,具有很高的观赏价值。但是,由于它生长于海拔较高的地方,且生长环境特殊,同时受季节和母本材料等的限制,导致目前无法进行大量的商品化生产。
杜鹃花的繁殖方式多样,常见的有种子繁殖、扦插繁殖、压条繁殖以及嫁接繁殖等[1]。不过,在杜鹃花科植物里,多数种类在扦插繁殖时生根困难,即便成功生根,受多种因素制约,也往往难以存活[2]。此外,播种、扦插和嫁接等繁殖方法易受季节和母株材料的限制,这使得杜鹃的繁殖系数下降,生长周期延长,不适合大规模的商业化生产[3]。
植物组织培养技术在繁育观赏植物方面优势显著,它具有繁殖系数高、繁殖速度快、不受季节影响且易于产业化等特点[4]。由于组织培养属于无性繁殖,后代发生变异的概率较低。而且与常规的扦插、嫁接、种子繁殖等方法相比,其繁殖速度大幅提升,繁殖率也相当高[5]。
目前,国内针对杜鹃花的研究主要聚焦于种子繁殖、扦插繁殖、压条繁殖、嫁接繁殖以及植物分类学等领域,而关于其组培快繁体系构建的研究报道相对较少[6]。在杜鹃资源的组织培养研究中,仅针对少数种类开展过相关工作[7,8],关于喇叭杜鹃组织培养的研究更是鲜见。基于此,本试验致力于构建喇叭杜鹃的组织培养体系,期望能为其商品化生产提供基础支撑。
本试验以峨眉山野生喇叭杜鹃种子为材料,对喇叭杜鹃种子外植体消毒、诱导分化、增殖培养、生根培养进行系统研究,建立喇叭杜鹃的快繁技术体系,为进一步开展喇叭野生杜鹃的种质资源保存、新品种选育和繁育推广工作提供参考依据。
1/材料与方法
1.1试验材料
试验材料为喇叭杜鹃(Rhododendrondiscolor)的成熟种子,均采自海拔1000m以上的峨眉山风景区,并常温储存。试验前将成熟果荚剥开,取出种子,去除杂质;选取颗粒饱满、无虫害、病害的种子备用。
1.2试验方法
1.2.1种子最佳灭菌时长的筛选
用纱布包裹种子,并置于流水下冲洗10min,随后移入超净台进行灭菌。先用75%酒精漂洗30s,无菌水清洗3遍;再用2%次氯酸钠分别消毒1、2、3、4、5min,消毒后用无菌水冲洗5遍。将消毒后的种子放在滤纸上吸干水分后种接种于不添加激素的1/2MS培养基(蔗糖30g/L,琼脂8g/L,pH值调至5.8-6.0)。每个处理4瓶,每瓶10粒种子,每个处理重复3次。接种30d后统计污染率和发芽率,观察萌发情况。
1.2.2启动培养
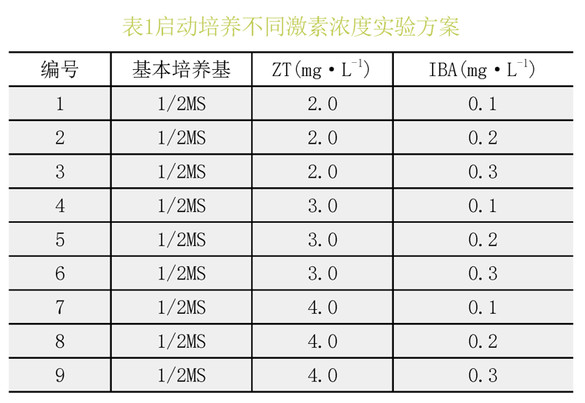
启动培养是植物组织培养快速繁殖过程的基础,其目的是得到无菌材料,并使外植体发育。将培养基1/2MS上所得的喇叭杜鹃无菌材料,接种于含有不同浓度ZT和NAA的1/2MS培养基中进行初代培养。每瓶接种3个茎段,每个处理6瓶,每个处理重复3次,培养50d后统计结果。(表1)
1.2.3继代增殖培养
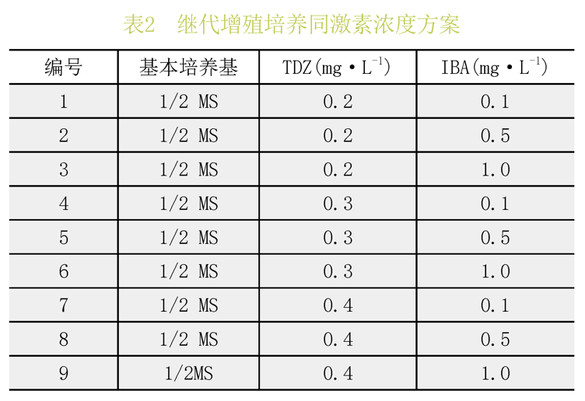
将初代培养获得的丛生芽切割成约1cm长、含单个芽的节段,接种至含有不同浓度TDZ和IBA的1/2MS培养基中。每瓶接3个芽,每个处理组6瓶,重复3次,培养50d观测结果。(表2)
1.2.4壮苗培养
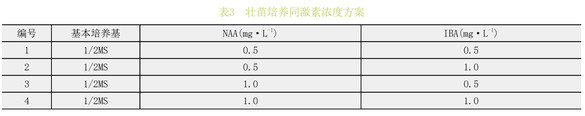
将不定芽增殖产生的继代苗进行壮苗培养,接种至含有不同浓度的NAA和IBA的1/2MS培养基中进行培养,每瓶接种3株,每个处理10瓶,重复3次,50d后观察生长状况。(表3)
1.2.5生根培养
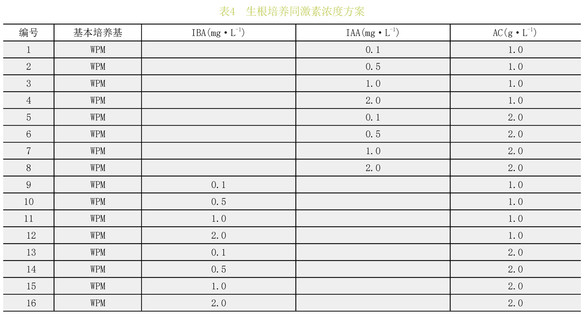
将在壮苗培养基上长度达到3cm,叶片4叶以上、叶色深绿、健壮的芽进行生根培养。接种至添加不同激素浓度的IBA和IAA的WPM培养基中进行培养,每个处理组6瓶,每瓶接苗3株,设3次重复,60d后观察并统计生根情况。(表4)
2/结果与分析
2.1 消毒时长对种子灭菌的影响
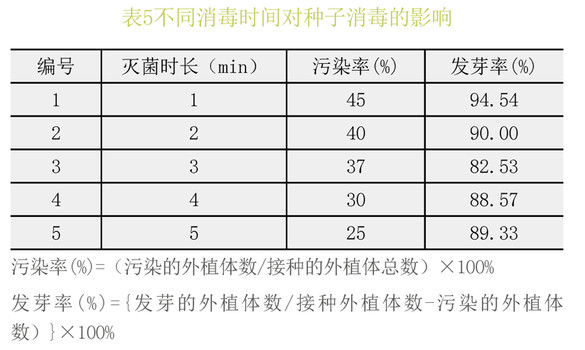
由表5可以看出,利用2%次氯酸钠对喇叭杜鹃进行灭菌时,增加灭菌时间可以显著降低种子的污染率,但随着消毒时间的增加,发芽率呈先下降后上升的趋势。综合考虑,喇叭杜鹃最合适消毒时间是2%次氯酸钠灭菌2min。
2.2启动培养
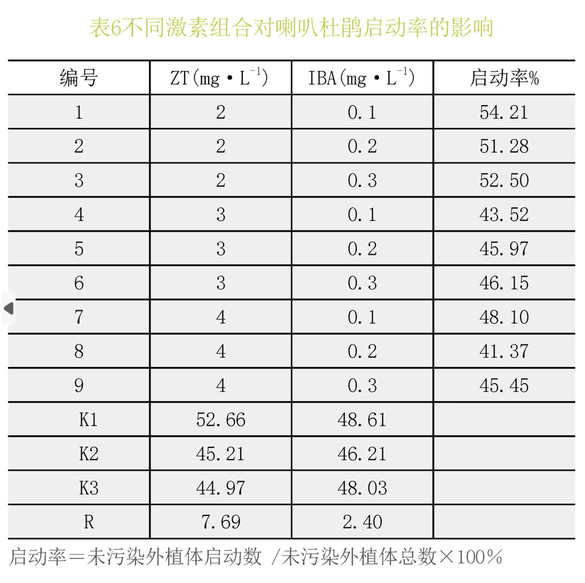
由表6极差分析可以看出,不同浓度的IBA与ZT的组合对喇叭小苗的启动率有一定影响,9种处理下的启动率存在明显差异,最优的激素组合为ZT2.0mg.L-1+IBA0.1mg.L-1。
2.3继代增殖培养
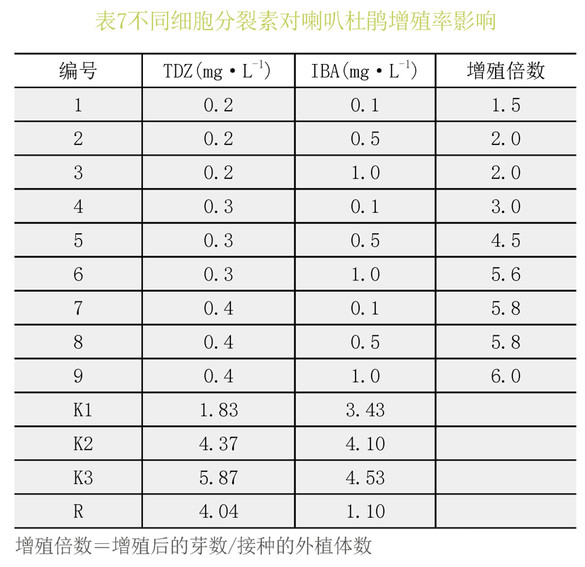
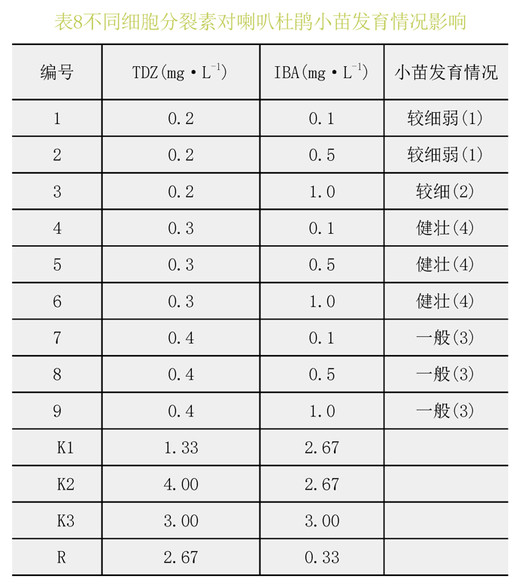
表7、8极差分析可见:TDZ对喇叭杜鹃的增殖效果较好,在供试浓度范围内,随着TDZ浓度的升高,增殖倍数也提高,但幼苗发育一般,综合考虑最适宜喇叭杜鹃增殖的激素组合为TDZ0.3mg.L-1+IBA1.0mg.L-1。
2.4壮苗培养
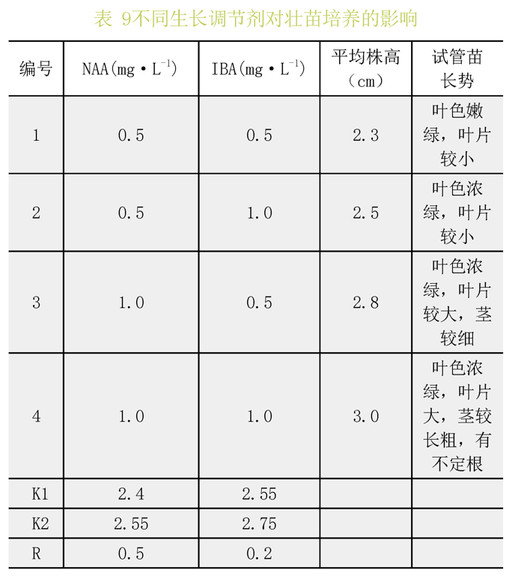
由表9通过极差分析和试管苗长势可以看出,当NAA和IBA浓度均为1mg·L-1时,试管苗的平均株高最高,且长势最好。最适宜喇叭杜鹃壮苗的激素组合为NAA1.0mg·L-1+IBA1.0mg·L-1。
2.5生根培养
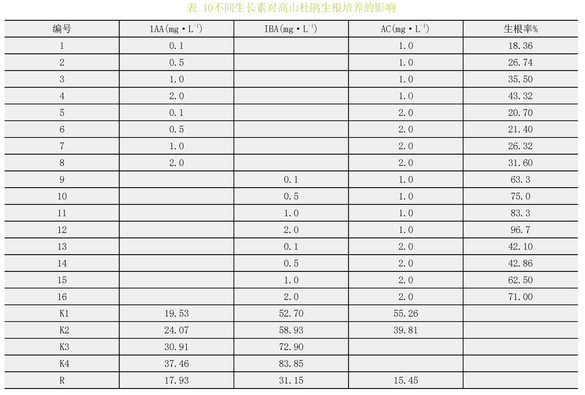
以WPM为基本培养基,培养基中分别添加不同浓度的IBA和IAA,经过40d培养后统计生根率。根据极差大小,IBA对高山杜鹃生根率的影响最显著,其次是IAA,AC的影响相对最小。结果表明(表10):16个处理中12号处理的生根率最高,为96.7%;在这16个处理中可以发现,含有IBA的处理中,生根率普遍高于含有IAA的。含有IAA的8个处理中,生根率最高仅达到43.32%。而含IBA的8个处理中,生根率最高达96.7%。这说明在生根培养中,IBA比1AA能更好的促进植株生根。综上所述,最适宜喇叭杜鹃生根的培养基为WPM+IBA2mg·L-1+AC1.0mg·L-1。
3/讨论
3.1消毒方式对外植体的影响
在无菌播种,常用的消毒剂有升汞、次氯酸钠、乙醇等,一般采取多种灭菌联合使用可以提高灭菌效果[9],升汞的消毒效果最好,但其对植物材料的伤害较大。次氯酸钠可以水解形成次氯酸,通过细菌的细胞壁,其强氧化性破坏菌体和病毒上的蛋白质等酶系统,从而杀死微生物,不易残留,对环境无害[10]。因此,本试验采用75%酒精和2%次氯酸钠联合处理对喇叭杜鹃种子进行灭菌。结果表明,采用此种方式进行灭菌,种子污染率最低,萌芽率最高。对喇叭杜鹃的最佳灭菌时间为2min。
3.2植物生长调节剂对喇叭杜鹃组织培养的影响
3.2.1植物生长调节剂对启动培养的影响
在开展启动培养工作时,本研究挑选ZT作为细胞分裂素。钟宇[11]等人在其研究里指出,ZT具备较强的诱导分化能力。陈幼妹[12]在相关研究中运用了改良后的1/4MS培养基,经过实验得出,在此培养基条件下相对更为优良的激素组合是1/4MS+ZT2mg·L-1+IAA0.5mg·L-1。何芳兰[13]在组培研究中同样采用了ZT与IBA的组合方式,最终确定最佳启动组合为ZT1mg·L-1+IBA0.05mg·L-1。此外,黄萍萍[14]在研究过程中发现,当ZT浓度处于1-3mg·L-1范围时,诱导率和诱导系数会随着浓度的升高而上升,由此得出,高山杜鹃(蒙他瑰)在1/4MS培养基上相对理想的激素组合为ZT2mg·L-1+IAA0.5mg·L-1。然而,本试验所得到的最佳启动培养组合是1/2MS+ZT2mg·L-1+IBA0.1mg·L-1。
3.2.2植物生长调节剂对继代增殖的影响
在进行杜鹃培养时,通常会选用KT、6-BA、ZT等植物激素,而在国外,2-ip、TDZ的应用更为普遍。范玉清[15]的研究指出,TDZ活性较高,是培养那些较难培养的植物,特别是木本植物时较为适宜的细胞分裂素。基于此,本研究选择了噻苯隆(TDZ)作为细胞分裂素。
目前,关于杜鹃组织培养已有相关研究。苗永美[16]采用TDZ和IBA组合对大树杜鹃、桃叶杜鹃的愈伤组织进行增殖培养,结果显示增殖率均达到了100%。苗永美[16]最终确定的增殖培养最佳激素组合为TDZ0.4mg·L-1+IBA0.05mg·L-1。而本试验所得到的最佳增殖配方为1/2MS+TDZ0.3mg·L-1+IBA1.0mg·L-1。
3.2.3植物生长调节剂对瓶苗生根的影响
在木本植物中,杜鹃生长是比较缓慢的,其组培周期较长,组培苗的生根诱导也一直是个难题。喇叭杜鹃组培试验结果分析表明,基本培养基的生根诱导效果为WPM+IBA2.0mg·L-1+AC1.0mg·L-1,生根效果最好。添加AC后,生根效果显著,随着浓度的增加,生根率增大,这与吴雅文等迷人杜鹃的组培研究结果一致。
英文缩写注释:
MS:MurashigeandSkoogMedium,MS培养基,是植物组织培养中常用的一种基础培养基,含有较高浓度的氮、磷、钾等营养元素,能满足多数植物组织生长和分化的需求。
ZT:Zeatin,玉米素,一种天然的细胞分裂素,能促进植物细胞分裂、分化,诱导芽的形成和生长,在植物组织培养的启动培养和增殖培养中常被使用。
IBA:Indole-3-ButyricAcid,吲哚-3-丁酸,一种常用的生长素类植物生长调节剂,主要作用是促进植物生根,也能促进细胞伸长和分裂,在植物组织培养的生根培养及壮苗培养中应用广泛。
TDZ:Thidiazuron,噻苯隆,一种人工合成的细胞分裂素类植物生长调节剂,活性较高,能有效诱导植物组织分化、促进芽的增殖,尤其在一些难培养植物(如木本植物)的组织培养中效果显著。
NAA:1-NaphthaleneaceticAcid,α-萘乙酸,一种广谱性生长素类植物生长调节剂,可促进植物细胞伸长和分裂,诱导生根,也能用于防止器官脱落、促进果实发育等,在植物组织培养的壮苗培养和生根培养中较为常用。
WPM:WoodyPlantMedium,木本植物培养基,专为木本植物组织培养设计的一种培养基,其氮、磷浓度相对较低,更符合木本植物组织生长的营养需求,在木本植物(如杜鹃)的生根培养中应用较多。
IAA:Indole-3-AceticAcid,吲哚-3-乙酸,是植物体内天然存在的一种生长素,能促进植物细胞伸长、分裂和分化,参与植物生长发育的多个过程,如根的形成、茎的伸长等,在植物组织培养中也可用于诱导生根。
AC:ActivatedCarbon,活性炭,在植物组织培养中,活性炭具有吸附培养基中有害物质(如酚类物质)、调节培养基pH值、提高培养基透气性等作用,同时也能促进植物生根,改善组培苗的生长状况。
参考文献:
[1]林魁,魏云华,魏宾斌.高山杜鹃组培快繁研究进展[J].现代农业科技,2017(13):144-145.
[2]何俊蓉,袁宁,吴洁,等.高山杜鹃组织培养研究现状[J].四川林业科技,2008,29(4):52-55.
[3]郑茜子.不同花色系杜鹃色素分析及美容杜鹃组培快繁体系建立[D].陕西杨凌:西北农林科技大学,2016.
[4]宋慧娟,庄雪影.毛棉杜鹃组培苗的生长基质筛选研究[J].林业科技通讯,2015(8):21-24.
[5]吴福建.比利时杜鹃(RhododendromhybridumHort.)组织培养及花发育的研究[D].哈尔滨:东北农业大学,2007.
[6]丁洪玲.牛皮杜鹃组织培养及植株解剖学研究[D].吉林延吉:延边大学,2008.
[7]李金月.杜鹃花组织培养研究进展[J].北京农业,2014(18):1.
[8]王亦菲,孙月芳,周润梅,等.二种西洋杜鹃的组织培养[J].上海农业学报,2003,40(1):25-29.2004.
[9]范俊岗,绿萝组织培养及离体再生体系研究[D].四川农业大学,2009.
[10]高文强,樊金会,赵红霞,等.杜鹃花组培快繁技术的研究[J].山东林业科技,2011(5):47-49
[11]钟宇,张健,罗承德,等.西洋杜鹃组织培养技术体系研究(II)培养物的增殖和生根[J].四川农业大学学报,2001,19(2):141-143.
[12]陈幼妹.高山杜鹃组织培养快速繁殖技术研究[J].现代农业科技,2008(17):13-14.
[13]何芳兰.高山杜鹃组织培养关键技术研究[D].兰州:甘肃农业大学,2006.
[14]黄萍萍.高山杜鹃(蒙他瑰)快速繁殖技术研究[J].福建农业科技,2004(3):23-24.
[15]范玉清.国外杜鹃花组织培养发展概况[J].生物学杂志,1996(2):30-31.
[16]苗永美.几种杜鹃组织培养技术研究[D].成都:四川农业大学,2004.
版权归原作者所有。如认为内容侵权,请联系我们删除。
- 主办:重庆市风景园林学会承办:重庆立意园林咨询有限公司
- 学会电话:(023)68801472 63673736 63673738 63892447QQ:944865067
- 地址:重庆菜袁路205号世纪花城A栋3楼
- 渝ICP备11002947号-1 渝公网安备 50010302002828号


